哈佛科学家揭开了青霉素炸开细菌的50年谜题!
1928年,青霉素出现在了弗莱明先生的培养皿上,让原本生长着葡萄球菌的培养基出现了一个“空白圈”,开启了人类使用抗生素对抗细菌的大门。为了破解那个“空白圈”——青霉素的杀菌机制——之谜,科学家在显微镜底下观察了青霉素对细菌的杀伤作用。
结果看到了让人惊讶的一幕。
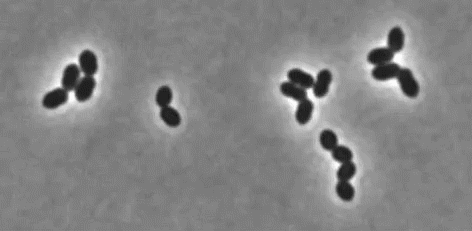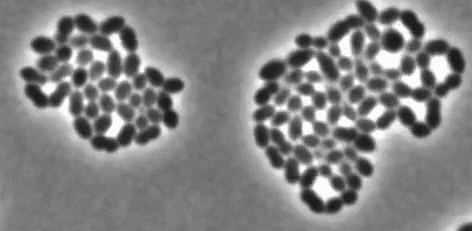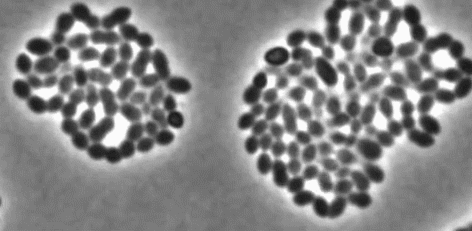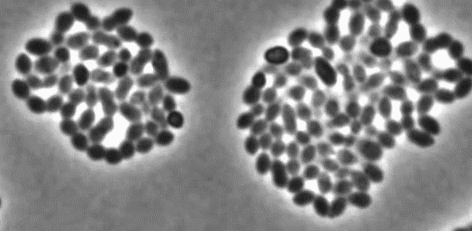
细菌一个接一个,嘭!嘭!嘭!地爆炸了……
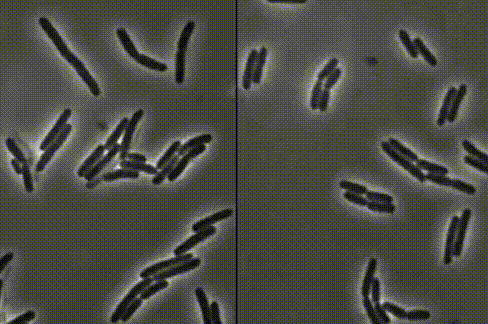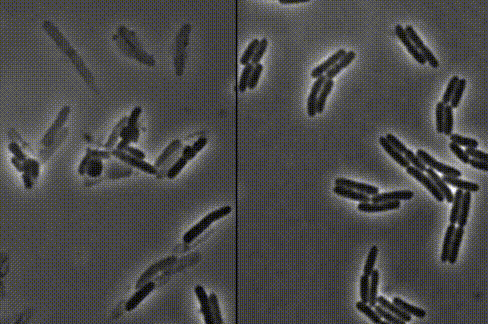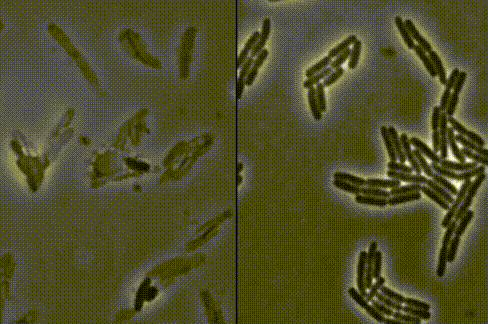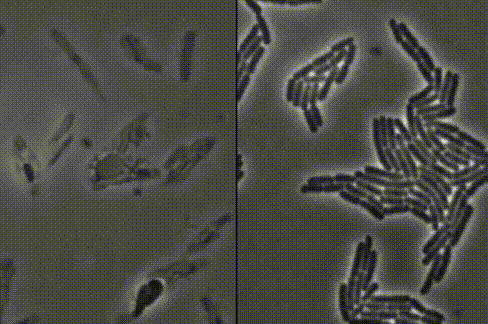
左:接连破裂的细菌 右:正常生长的细菌
青霉素究竟是如何引爆了细菌?
随后,经过近30年的探索,有很多科学家认为,这主要是因为作为β-内酰胺类抗生素,青霉素能与细胞壁合成酶青霉素结合蛋白(PBP)结合,抑制细菌细胞壁中肽聚糖的交联[1],最终导致细胞壁越来越脆弱,细菌最终像过度吸水的大豆撑破细胞壁一样,炸裂而亡。
这一传统认知,在1970年被打破。来自洛克菲勒大学的三位科学家,用他们开创性的研究成果改变了上述观点:青霉素让细菌爆炸,依赖于一种降解细胞壁肽聚糖的酶——自溶素[2]。

(图源:dpma.de)
一石激起千层浪。
随后,科学家发现β-内酰胺类抗生素诱导的其他细菌爆炸,都是依赖于自溶素。
在细菌的生长过程中,自溶素参与了许多关键的细胞过程,对细菌的生长极其重要。令人遗憾的是,自溶素等肽聚糖降解酶是如何被精密调控,以及这个过程是如何被青霉素破坏的这两个问题,至今无人能解。
来自哈佛医学院的David Rudner教授领衔的研究团队,终于破解了这个困扰学界近50年的谜题,发现了青霉素让细菌“爆炸”的秘密。文章发表在著名期刊eLife上[3]。在耐药菌频现的今天,Rudner教授的这个新发现,对于开发新的抗生素意义非凡。

通讯作者Rudner教授(图源:harvard.edu)
在揭秘Rudner教授团队的发现之前,有必要给大家介绍下细菌的生长繁殖过程,以及已经发现的青霉素的作用机制。
细菌细胞和人体细胞最主要的差别之一,就是细菌有细胞壁,而人体细胞没有。青霉素等β-内酰胺类抗生素正是基于这个差别,强效狙击细胞壁,杀灭细菌,而不伤害人体细胞。
我们都知道,根据细菌的细胞壁组成,细菌可以通过染色分为革兰氏阳性和革兰氏阴性细菌,其中革兰氏阳性菌细胞壁含有肽聚糖。肽聚糖像个盔甲一样,保护着细菌柔软的原生质体,避免原生质体因过度吸水而被涨破。之前的研究认为,青霉素的作用靶点是肽聚糖合成酶PBP。青霉素抑制PBP活性,导致细胞壁变得脆弱,最终破裂而死。这与科学家在显微镜下观察到的现象也是吻合的。
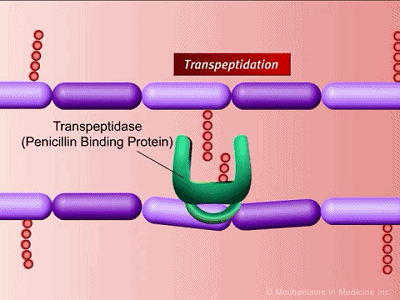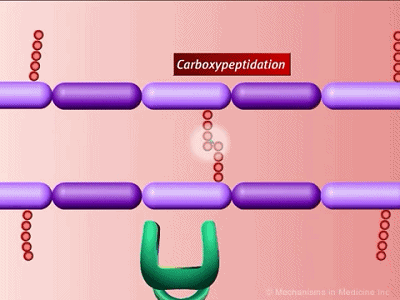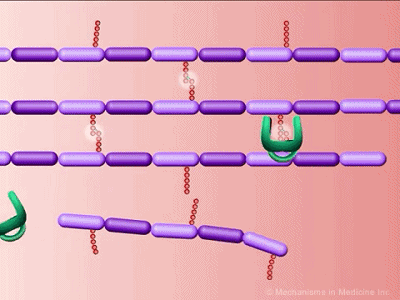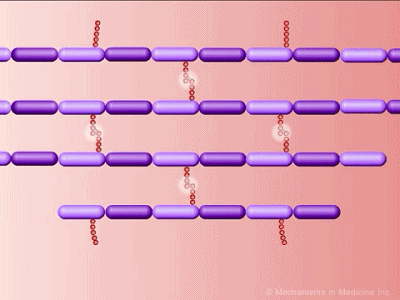
细胞壁肽聚糖链接示意图,绿色为PBP
不过,洛克菲勒大学的三位科学家却在1970年发现,抑制肺炎链球菌的自溶系统,可以让这些细菌对青霉素产生耐药性。
怎么抑制了一条与青霉素作用机制无关的通路,就让原本对青霉素敏感的细菌耐药了呢?答案竟然是,青霉素的抗菌机制依赖于肽聚糖的降解机制,而抑制肽聚糖的合成实际上是不足以导致细菌爆炸的。
那么青霉素又是如何调节细菌的肽聚糖的降解的呢?Rudner教授团队解开了这个谜题。
我们都知道,细菌会长大,而且在分裂的时候会直接一分为二,这些生命活动需要细胞壁分裂或者露出一些小缺口[4,5]。
那么,在存在一个坚实细胞壁的情况下,细菌究竟是如何完成上述过程的呢?其实,细菌老早就给自己准备了可以分解细胞壁的酶——肽聚糖水解酶(LytA),也就是前面介绍的自溶素。以肺炎链球菌为例,在细菌的生长繁殖过程中,肽聚糖水解酶是一直存在的。甚至在细菌快速繁殖的指数生长期,肽聚糖水解酶都保持着较为稳定的水平。
而当细菌生长到了稳定期,少数细菌就会出现类似青霉素处理引起的炸裂现象。科学家将这种现象称为“自溶”。出现自溶的原因,就是肽聚糖水解酶LytA等自溶素失控导致的。
那肽聚糖水解酶这把双刃剑是如何被细菌控制的呢?
原来,在正常情况下,肽聚糖水解酶是被一种叫做细胞膜磷壁酸(LTAs)的物质固定在细胞膜上的,由于细胞膜与细胞壁之间有一定的距离,所以肽聚糖水解酶与细胞壁相安无事。
不过呢,膜磷壁酸的形成,受一个叫做TacL的酶控制[7]。如果TacL没了,膜磷壁酸就不能形成,与此同时,另外一种叫做细胞壁磷壁酸(WTAs)的物质就大量合成了。而这个细胞壁磷壁酸也能固定肽聚糖水解酶,如此这般,肽聚糖水解酶就被固定到细胞壁上,开始对细胞壁上的肽聚糖进行降解。
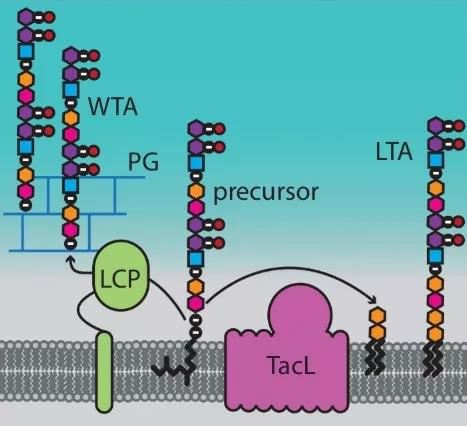
磷壁酸合成的那些事儿
写到这里,恐怕你已经猜到了,青霉素影响的应该就是这个TacL。
的确如此,当研究人员把青霉素加入肺炎链球菌的培养基,果然发现了TacL水平降低,原本被固定在细胞膜上的肽聚糖水解酶转移到了细胞壁上,肽聚糖被降解,细胞失去细胞壁保护,大量水涌入细胞,细胞膜不堪重负。
终于,炸了。
在研究人员的努力下,终于揭开了肽聚糖水解酶的调控蛋白TacL的神秘面纱,也进一步解释了始祖抗生素青霉素是如何打击犯罪爆破肺炎链球菌的。当然,最重要的是,为消灭致病菌提供了新的靶点和治疗思路。
但是,抗生素和细菌的这场battle,还没有结束~
参考资料:
[1] Park JT, Strominger JL. Mode of action of penicillin[J]. Science,1957,125:99–101.
[2]Tomasz A, Albino A, Zanati E, et al. Multiple Antibiotic Resistance in a Bacterium with Suppressed Autolytic System[J]. Nature, 1970, 227(5254): 138-140.
[3]Flores-Kim J, Dobihal G S, Fenton A, et al. A switch in surface polymer biogenesis triggers growth-phase-dependent and antibiotic-induced bacteriolysis[J]. eLife, 2019, 8: e44912.
[4]De Las Rivas B, García J L, López R, et al. Purification and polar localization of pneumococcal LytB, a putative endo-β-N-acetylglucosaminidase: the chain-dispersing murein hydrolase[J]. Journal of bacteriology, 2002, 184(18): 4988-5000.DOI:10.1128/JB.184.18.4988-5000.2002
[5]Bisicchia P, Noone D, Lioliou E, et al. The essential YycFG two‐component system controls cell wall metabolism in Bacillus subtilis[J]. Molecular microbiology, 2007, 65(1): 180-200. DOI:10.1111/j.1365-2958.2007.05782.x
[7]Heß N, Waldow F, Kohler T P, et al. Lipoteichoic acid deficiency permits normal growth but impairs virulence of Streptococcus pneumoniae[J]. Nature communications, 2017, 8(1): 2093. DOI:10.1038/s41467-017-01720-z
来源:公众号“奇点网”
作者:王雪宁 BioTalker
注: 本网所有转载文章仅作为传递信息使用,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(zk_share@163.com),我们将立即进行删除处理。